QUANDO
HISTÓRIA DA CANÁBIS PARA FINS MEDICINAIS
A planta da canábis é utilizada na medicina há milhares de anos. Saiba mais sobre a sua longa jornada e de que forma o conhecimento sobre canábis se desenvolveu significativamente com o passar dos anos.
Quando é que as pessoas começaram a utilizar canábis para fins medicinais?
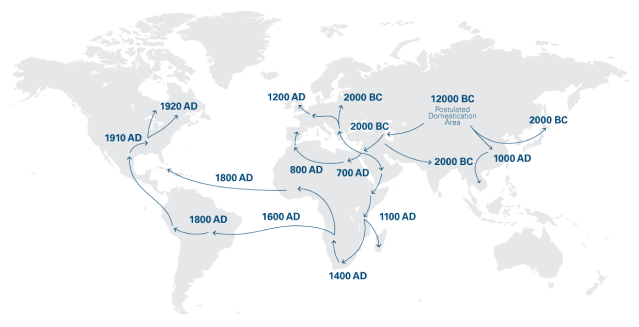
A canábis é uma das plantas mais antigas do mundo a ser utilizada para fins medicinais. Sabe-se que a canábis foi cultivada na China já em 12.000 a.C. A primeira prova documentada da utilização da canábis para fins medicinais data de aproximadamente 4000 a.C. A canábis para fins medicinais chegou à Europa na Antiguidade, tendo sido utilizada nas civilizações Grega e Romana. 1
Quando é que a canábis para fins medicinais começou a ser utilizada na medicina tradicional?
A história da canábis medicinal começou a ser contada em português no ano de 1563, pelo médico Garcia de Orta. No seu livro “Colóquio dos simples, e drogas e coisas medicinais da Índia” descreveu as propriedades medicinais da canábis.2 O uso medicinal da canábis foi introduzido pela primeira vez na medicina ocidental no século XIX. A utilização da canábis rapidamente se espalhou por toda a Europa Ocidental e América do Norte, onde os médicos a utilizaram para tratar as mais variadas condições médicas. 1
Quando é que a canábis para fins medicinais deixou de ser utilizada na medicina ocidental?
Durante as décadas de 1920 e 1930, dois fatores contribuíram para que a canábis deixasse de ser considerada um medicamento no mundo ocidental. Primeiro, os medicamentos à base de plantas não conseguiam oferecer a quantificação necessária de substâncias ativas e, por conseguinte, a indústria farmacêutica começou a desenvolver fármacos à base de substâncias químicas. Segundo, a canábis estava a tornar-se estigmatizada, particularmente nos EUA, sobretudo pelo seu uso recreativo.1 Finalmente, estes dois fatores levaram à inclusão da canábis, em 1961, na lista de substâncias constantes da Tabela IV da Convenção Única das Nações Unidas, juntamente com a cocaína e a heroína. Em dezembro de 2020, as Nações Unidas fizeram uma revisão à classificação da canábis, com base na recomendação da Organização Mundial da Saúde (OMS), uma vez que se trata de uma substância com reconhecido valor terapêutico. 3
O que aprendemos sobre canábis para fins medicinais nos últimos 100 anos?
Em meados do século XX, investigadores descobriram substâncias químicas na planta da canábis que são responsáveis pelos seus efeitos medicinais. Uma das descobertas mais importantes foi o isolamento e a identificação do delta-9-tetrahidrocanabinol (THC). Nos finais do século XX, os investigadores começaram a desvendar os alvos biológicos destas substâncias químicas, incluindo os chamados recetores canabinoides presentes no organismo. 1 Desde então, o interesse na investigação desta área aumentou exponencialmente. Por exemplo, em 1990, havia cerca de 70 publicações relacionadas com canabinoides (por ano) nas revistas científicas em todo o mundo; esse número aumentou para mais de 200 em 2000, mais de 600 em 2010, quase 2000 em 2019 e mais de 2500 em 2020. 4
Quando é que a canábis para fins medicinais foi legalizada em Portugal?
O regime atual da canábis para fins medicinais em Portugal foi aprovado em 2018 na Assembleia da República (apesar das primeiras normas que previam a possibilidade deste uso datarem de 1924. Portugal também acrescentou, em 1926, pelo Decreto n.º 12:210, de 24 de agosto, os “preparados galénicos (extracto e tintura) de cânhamo índio” (Decreto n.º 12:210), continuando a prever regras especiais de receita médica, registos exigentes para as transações, autorizações para o desenvolvimento de atividades e procedimentos detalhados para a sua importação e exportação. 5 Os medicamentos, preparações e substâncias à base da planta da canábis só estão disponíveis mediante prescrição médica e só são vendidos nas farmácias. Além disso, todas as formas de canábis para fins medicinais devem ser licenciadas pela Autoridade Nacional do Medicamento e Produtos de Saúde (Infarmed), a entidade reguladora que supervisiona os produtos medicinais e de saúde em Portugal. 6,7

Quando é que o primeiro produto de canábis para fins medicinais foi produzido em Portugal?
Em fevereiro de 2021, a Tilray foi a primeira empresa em Portugal a receber autorização de colocação no mercado de uma substância à base de canábis, de acordo com a legislação portuguesa, para disponibilizar flor seca da planta da canábis para fins medicinais a pessoas com doença severa, nos casos em que os medicamentos convencionais não atinjam os efeitos desejados ou produzam efeitos secundários relevantes, e de acordo com uma lista de indicações terapêuticas consideradas adequadas pelo Infarmed. Trata-se de um produto feito nas instalações da Tilray, que possuem certificado de boas práticas de fabrico (GMP), em Cantanhede, Portugal. 8
Sativex®, foi o primeiro medicamento a obter Autorização de Introdução no Mercado em Portugal em 2012, indicado como tratamento para a melhoria dos sintomas em doentes adultos com espasticidade moderada a grave devida a esclerose múltipla (EM), que não responderam de forma adequada a outra medicação antispástica e que demonstraram uma melhoria clinicamente significativa dos sintomas relacionados com a espasticidade durante um ensaio inicial da
terapêutica. 9,10